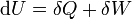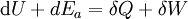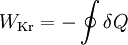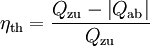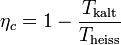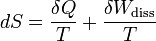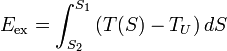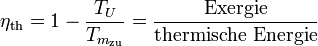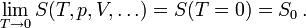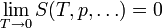Thermodynamik
Die Thermodynamik (von altgriechisch thermós „warm“ sowie dýnamis „Kraft“), auch als Wärmelehre bezeichnet, ist ein Teilgebiet der klassischen Physik. Sie ist die Lehre der Energie, ihrer Erscheinungsformen und ihrer Fähigkeit, Arbeit zu verrichten.
Die Thermodynamik bringt Größen wie Energie, Wärme, geleistete Arbeit, Druck und Volumen miteinander in Zusammenhang. Sie erlaubt Aussagen darüber, welche Änderungen an einem System möglich sind und erlaubt Angaben über die hierzu erforderlichen Druck- und Temperaturbedingungen. Sie macht aber keine Aussagen darüber, wie schnell die Prozesse ablaufen oder was dabei mikroskopisch im einzelnen geschieht.
Die Thermodynamik dient zur
Berechnung von frei werdender
Wärmeenergie, von Druck-, Temperatur-
oder Volumenänderungen sowie zur
Berechnung von anteiligen Komponenten.
Die Thermodynamik hat auch große Bedeutung für das Verständnis und die Planung von Prozessen in Chemieanlagen, bei Wärmekraftmaschinen sowie in der Heizungs- und Klimatechnik.
Man nennt Druck, Temperatur, Volumen, Konzentration, usw. Zustandsgrößen. Zustandsgrößen sind durch eine Zustandsgleichung verknüpft (z. B. ideales und reales Gasgesetz). Es genügt die Kenntnis der thermodynamischen Zustandsgleichung, um aus einigen Zustandsgrößen (z. B. Druck, Volumen) andere Zustandsgrößen (z. B. Temperatur) berechnen zu können.
Ein thermodynamisches System ist ein räumlich eingegrenzt betrachtetes physikalisches System, für das eine Energiebilanz – beim offenen System zusammen mit einer Stoffbilanz – erstellt werden kann.
In der Physik (Thermodynamik) unterscheidet man offene, geschlossene
und abgeschlossene (oder isolierte) Systeme.
Bei einem offenen System bezieht man zusätzlich die Umgebung (z. B. bei Wärmeabstrahlung, Materieaustausch) mit ein. Einige Berechnungen beziehen sich auf abgeschlossene Systeme, hierbei findet kein Energie- oder Materieaustausch mit der Umgebung statt. Dabei bleibt nach dem Energieerhaltungssatz die Summe aller Energieformen (z. B. Wärme, mechanische Arbeit, chemische Energie, elektrische Energie) konstant.
Als geschlossen (≠ abgeschlossen!) ist ein System definiert, das zwar Energie aber keine Materie (bzw. Teilchen) mit seiner Umgebung austauschen kann. Die Vorstellung des geschlossenen Systems rechtfertigt sich durch das praktische Erfordernis des außen stehenden Beobachters.
Ein Beispiel für ein geschlossenes thermodynamisches System ist ein Druckkochtopf, der zwar Energie in Form von Wärme aufnimmt und abstrahlt, jedoch keinen Wasserdampf abgeben kann. Ist jedoch ein System in einer Weise geschlossen, dass es keine thermische Energie mit seiner Umgebung austauschen kann, so sind die darin ablaufenden Prozesse adiabatisch. Hingegen tauschen abgeschlossene Systeme mit ihrer Umgebung weder Energie noch Materie aus.
In der Technik werden Systeme, die mit einem hermetischen Verschluss vor einem Stoffaustausch bewahrt werden, als (hermetisch) geschlossene Systeme bezeichnet. Weiterhin spricht man dort auch von einem geschlossenen System, wenn die von außen einwirkenden Kräfte gegenüber den Kräften im System vernachlässigbar gering sind.
Eine intensive Größe ist eine Zustandsgröße, die sich bei unterschiedlicher Größe des betrachteten Systems nicht ändert. Man unterscheidet hierbei systemeigene intensive Größen, wie beispielsweise Temperatur und Druck, und stoffeigene intensive Größen, wie alle molaren und spezifischen Größen reiner Stoffe.
Das Gegenstück zu den intensiven Größen sind die extensiven Größen, wie beispielsweise Teilchenzahl, Volumen, Masse und Entropie, welche sich mit der Größe des Systems ändern (Skalierung). Das System wird also volumen- und massenmäßig (+andere Größen) vergrößert oder verkleinert.
Die Abhängigkeit einer Größe vom betrachteten System kann beispielsweise anhand zweier identischer Systeme, die durch eine Zwischenwand getrennt sind, leicht nachvollzogen werden. Hebt man diese Trennung auf, so wird der Unterschied zwischen intensiven und extensiven Größen deutlich. Alle Größen, die nun den gleichen Wert wie vor der Entfernung der Zwischenwand besitzen, sind intensive Größen. Alle Größen, die einen anderen Wert besitzen, sind hingegen extensive Größen.
Es ist hierbei auch möglich, extensive Größen in intensive Größen umzuwandeln, indem man diese auf eine bestimmte Masse (spezifische Größe) oder eine bestimmte Stoffmenge (molare Größe) bezieht. So ist zwar das Volumen eine extensive Größe, das molare Volumen stellt im Gegensatz hierzu jedoch eine intensive Größe dar.
Dabei werden intensive Zustandsgrößen (beispielsweise Temperatur T, Druck p und chemisches Potential μ) von extensiven Zustandsgrößen (beispielsweise innerer Energie U, Entropie S, Volumen V und Teilchenzahl N) unterschieden. Die Arbeit W und die Wärme Q sind keine Zustandsgrößen, da sie nicht vom Zustand des Systems zu einem gegebenen Zeitpunkt, sondern von seiner gesamten Vorgeschichte abhängen.
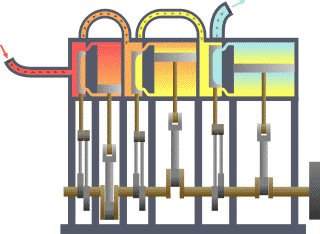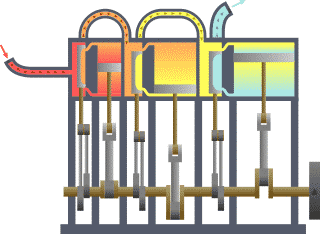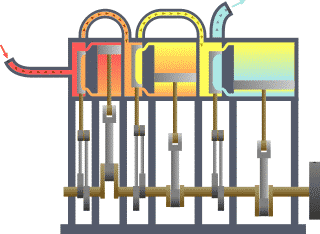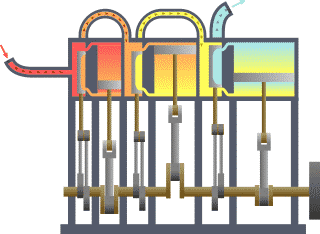
Typischer thermodynamischer Vorgang am Beispiel der prinzipiellen Wirkungsweise eines durch Dampf betriebenen Motors (rot = sehr heiß, gelb = weniger heiß, blau = Endtemperatur des Mediums)
Geschichte
Der französische Physiker Nicolas Léonard Sadi Carnot untersuchte die Wärmemengen einer Dampfmaschine (1824). Er stellte fest, dass heißer Wasserdampf ein kälteres Wasserreservoir erwärmt und dabei mechanische Arbeit geleistet wird. Carnot vermutete, dass bei diesem Prozess keine Wärme verloren geht. Carnot beschrieb die Vorgänge in der Dampfmaschine als Kreisprozess, die in späteren Jahren von Benoît Pierre Émile Clapeyron in mathematischer Form dargestellt wurde (Carnotscher Kreisprozess).
Der deutsche Arzt Julius Robert Mayer formulierte (1841) die These, dass Energie in einem abgeschlossenen System eine konstante Größe sein sollte. Energie kann nicht verschwinden, sondern nur in eine andere Form umgewandelt werden. Diese Erkenntnis ist als Energieerhaltungssatz bekannt. Mayer machte Berechnungen zur Umwandlung von Wärme in mechanische Energie. Er gab an, wie viel Energie die Temperaturerhöhung von 1 g Wasser um 1 °C entspricht und berechnete, dass diese Energiemenge einer mechanischen Energie entspricht, die 1 g Materie 367 Meter in die Höhe heben könnte (tatsächlich sind es 426 Meter). Diese Berechnungen bildeten die Grundlage zum Ersten Hauptsatz der Thermodynamik James Prescott Joule bestimmte im Jahr 1844 noch genauer das mechanische Wärmeäquivalent.
Im Jahr 1840 veröffentlichte der deutsch-schweizerische Chemiker Hermann Heinrich Hess eine Abhandlung mit dem Titel „Thermochemische Untersuchungen“, die auf dem Satz von der Erhaltung der Energie bei Molekülen bzw. Atomen aufgrund von chemischen Reaktionswärmen basierte.
Während Carnot noch vermutete, dass die Wärmemengen bei einer Dampfmaschine vollständig erhalten bleiben, nahm Mayer eine Umwandelbarkeit von Energieformen ineinander an. Der deutsche Physiker Rudolf Clausius verknüpfte 1854 die Ideen von Mayer und Carnot. Er zeigte, dass beim Betreiben einer Dampfmaschine immer Wärme von einem wärmeren Reservoir auf ein kälteres Reservoir fließt und damit die Grundthese von Carnot korrekt ist. Jedoch bleibt die Wärmeenergie nicht – wie Carnot annahm – konstant, sondern sie wird zum Teil in mechanische Arbeit umgewandelt. Clausius stellte fest, dass die Wärmeenergie einer Maschine (Dampfmaschine) immer nur zu einem Teil in mechanische Arbeit umgewandelt werden kann; der andere Teil der Energie wird an die Umgebung abgegeben. Der Wirkungsgrad einer Maschine bestimmt das Umwandlungsverhältnis von mechanischer Energie in Wärme. Clausius Erkenntnis bildet den Zweiten Hauptsatz der Thermodynamik: „Es gibt keine periodisch arbeitende funktionierende Maschine, die nichts anderes tut, als Wärme in mechanische Arbeit zu verwandeln.“ Die Wärmemenge, die nicht zur mechanischen Arbeit genutzt werden kann, wird an die Umgebung abgegeben. Diese nicht nutzbare Wärmemenge verknüpfte Clausius mit der entsprechenden Temperatur zu einer neuen Funktion, der Entropie. Alle natürlichen Energieumwandlungsprozesse enthalten einen irreversiblen Entropieanteil, bei dem nicht genutzte Wärme an die Umgebung abgegeben wird. Entropie bedeutet eine „nach innen gekehrte, d. h. nicht mehr verwandlungsfähige oder nutzbare Energie." Später faßte Boltzmann, recht anschaulich, die Entropie als Maß der Unordnung der Bewegungen eines Systems auf.Nur in einem abgeschlossenen System und bei einer reversiblen Zustandsänderung bleibt die Entropiedifferenz zwischen Anfangs- und Endzustand gleich Null.
Allgemeine ZustandsgleichungDie allgemeine Zustandsgleichung beschreibt den Zustand des idealen Gases bezüglich der Zustandsgrößen Druck p, Volumen V, Temperatur T und Stoffmenge n bzw. Teilchenzahl N bzw. Masse m. Die Gleichung kann in verschiedenen, zueinander äquivalenten Formen formuliert werden, wobei alle diese Formen den Zustand des betrachteten Systems in gleicher Weise und eindeutig beschreiben.
Extensive Formen:
Intensive Form:
Hierbei stehen die einzelnen Formelzeichen für folgende Größen:
- kB - Boltzmannkonstante
- Rm - universelle oder molare Gaskonstante
- Rs - individuelle oder spezielle Gaskonstante
- ρ - Dichte
- vm - molares Volumen
- v - spezifisches Volumen
- N - Teilchenzahl
- n - Stoffmenge
- m - Masse
- M - Molare Masse
- T - Temperatur (in Kelvin)
- p - Druck
Die ideale Gasgleichung stellt den Grenzfall aller thermischen
Zustandsgleichungen für verschwindende Dichte 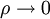 dar, das heißt für verschwindenden Druck bei genügend hoher Temperatur.
In diesem Fall kann man das Eigenvolumen der Gasmoleküle und die
Kohäsion – die anziehende Kraft zwischen den Molekülen –
vernachlässigen.
dar, das heißt für verschwindenden Druck bei genügend hoher Temperatur.
In diesem Fall kann man das Eigenvolumen der Gasmoleküle und die
Kohäsion – die anziehende Kraft zwischen den Molekülen –
vernachlässigen.
Die ideale Gasgleichung ist für viele Gase wie zum Beispiel wasserdampfungesättigte Luft auch bei Normalbedingungen eine gute Näherung. Aus der idealen Gasgleichung folgt, dass die Innere Energie eines Idealen Gases unabhängig von Druck und Volumen ist und nur von der Temperatur abhängt. Sie besteht nur aus der kinetischen Energie der Wärmebewegung der Moleküle.
Im Jahr 1873 erweiterte Johannes Diderik van der Waals das Gasgesetz zur Van-der-Waals-Gleichung, die das Eigenvolumen der Gasteilchen und die Anziehung zwischen ihnen im Gegensatz zur allgemeinen Gasgleichung mit berücksichtigt und somit auch als Näherung auf deutlich reale Gase angewendet werden kann. Eine andere Näherungslösung für reale Gase stellt die Reihenentwicklung der Virialgleichungen dar, wobei die allgemeine Gasgleichung identisch mit einem Abbruch der Reihenentwicklung nach dem ersten Glied ist. Generell gilt, dass die allgemeine Gasgleichung als Näherungslösung für schwach reale Gase bei geringen intermolekularen Wechselwirkungen, kleinen Drücken und hohen Temperaturen (großen Molvolumina) geeignet ist. Insbesondere weisen ideale Gase hierbei keinen Joule-Thomson-Effekt auf.
Spezialfälle
Es gibt verschiedene Spezialfälle des allgemeinen Gasgesetzes, welche einen Zusammenhang zwischen zwei Größen herstellen, während alle anderen Größen konstant gehalten werden. Erklärt und nicht nur empirisch abgeleitet werden diese Zusammenhänge zwischen den Zustandsgrößen eines Gases durch dessen Teilchencharakter, also durch die kinetische Gastheorie.
Gesetz von Boyle-Mariotte
Das Gesetz von Boyle-Mariotte, auch Boyle-Mariottesches Gesetz oder Boyle-Mariotte-Gesetz und oft mit Boyle'sches Gesetz abgekürzt, sagt aus, dass der Druck idealer Gase bei gleichbleibender Temperatur und gleichbleibender Stoffmenge umgekehrt proportional zum Volumen ist. Erhöht man den Druck auf ein Gaspaket, wird durch den erhöhten Druck das Volumen verkleinert. Verringert man den Druck, so dehnt es sich aus. Dieses Gesetz wurde unabhängig von zwei Physikern entdeckt, dem Iren Robert Boyle (1662) und dem Franzosen Edme Mariotte (1676): (isotherm)
Für T = const und n = const gilt:
Gesetz von Gay-Lussac
Das erste Gesetz von Gay-Lussac, auch Gay-Lussacsches Gesetz, Gesetz von Charles oder Charlessches Gesetz, besagt, dass das Volumen idealer Gase bei gleichbleibendem Druck und gleichbleibender Stoffmenge direkt proportional zur Temperatur ist. Ein Gas dehnt sich also bei einer Erwärmung aus und zieht sich bei einer Abkühlung zusammen. Dieser Zusammenhang wurde 1787 von Jacques Charles und 1802 von Joseph Louis Gay-Lussac erkannt.
Für p = const und n = const gilt:
Das eigentliche Gesetz von Gay-Lussac (obiges ist nur der Teil, den man meist als das Gesetz von Charles bezeichnet) lautet:
Hierbei ist T0 die Temperatur am Nullpunkt der Celsiusskala, also 273,15 K oder 0 °C. Demhingegen ist T die gesuchte Temperatur, wobei man darauf achten muss, die gleiche Einheit wie bei T0 zu verwenden. Analog ist V das Volumen bei T, V0 das Volumen bei T0 und γ0 der Volumenausdehnungskoeffizient bei T0, wobei für ideale Gase allgemein γ = 1/T gilt.
Aus dieser Gleichung kann man folgern, dass es einen absoluten Temperaturnullpunkt geben muss, da die Gleichung für diesen ein Volumen von Null voraussagt und das Volumen nicht negativ werden kann. Ihre empirische Basis ist daher auch Grundlage für die absolute Temperaturskala Kelvins, da hierüber durch Extrapolation der Temperaturnullpunkt bestimmt werden konnte.
2. Gesetz von Gay-Lussac
Das Gesetz von Amontons, oft auch 2. Gesetz von Gay-Lussac, sagt aus, dass der Druck idealer Gase bei gleichbleibendem Volumen und gleichbleibender Stoffmenge direkt proportional zur Temperatur ist. Bei einer Erwärmung des Gases erhöht sich also der Druck und bei einer Abkühlung wird er geringer. Dieser Zusammenhang wurde von Guillaume Amontons entdeckt.
Für V = const und n = const gilt:
Analog zum Gesetz von Gay-Lussac gilt hierbei auch:
Kurze Zusammenfassung der Hauptsätze
0. Hauptsatz: Stehen zwei Systeme jeweils mit einem dritten im thermodynamischen Gleichgewicht, so stehen sie auch untereinander im Gleichgewicht.
1. Hauptsatz: Energie kann weder erzeugt noch vernichtet, sondern nur in andere Energiearten umgewandelt werden.
2. Hauptsatz: Thermische Energie ist nicht in beliebigem Maße in andere Energiearten umwandelbar.
3. Hauptsatz: Der absolute Nullpunkt der Temperatur ist unerreichbar.
„Nullter“ Hauptsatz

Wenn ein System A sich mit einem System B sowie B sich mit einem System C im thermischen Gleichgewicht befindet, so befindet sich auch A mit C im thermischen Gleichgewicht.
Anders formuliert: das Gleichgewicht ist transitiv. Dies erlaubt es, eine neue Zustandsgröße, die empirische Temperatur θ, einzuführen, so dass zwei Systeme genau dann die gleiche Temperatur haben, wenn sie sich im thermischen Gleichgewicht befinden. Dieses Gesetz wurde erst nach den drei anderen Hauptsätzen formuliert. Da es aber eine wichtige Basis bildet, wurde es später als „nullter“ Hauptsatz bezeichnet. Es erklärt, warum ein Thermometer, das in Kontakt mit dem zu messenden Objekt steht, dessen Temperatur messen kann.
Allerdings ist im Gravitationsfeld zu beachten, dass das Gleichgewicht bei im Allgemeinen verschiedenen Temperaturen zwischen den Systemen A, B und C liegt, denn die Photonen der Schwarzkörperstrahlung erfahren im Gravitationsfeld aufgrund des Äquivalenzprinzips eine Rot-/Blau-Verschiebung; durch die Zeitdilatation werden sie in unterschiedlichen Höhen mit verschiedenen Raten emittiert. Zudem sind deren Flugbahnen gekrümmt, so dass nicht alle von unten startenden Photonen auch oben ankommen können. All diese Effekte bewirken eine mit der Höhe abnehmende Temperatur. Auf der Erde beträgt dieser Effekt aber nur 1,6·10-14K/m und ist daher unmessbar klein. Bei einem Neutronenstern ist er aber nicht vernachlässigbar.
Erster Hauptsatz
Bilanz für das geschlossene thermodynamische System
Der erste Hauptsatz der Thermodynamik ist aus dem Satz der Energieerhaltung abgeleitet: jedes System besitzt eine innere Energie U (=extensive Zustandsgröße). Diese kann sich nur durch den Transport von Energie in Form von Arbeit W und/oder Wärme Q über die Grenze des Systems ändern, das heißt:
Dabei ist W die Summe aus der Volumenarbeit und der im System dissipierten Arbeit (z. B. Reibungsarbeit). Die Gleichung gilt für das ruhende System. Beim bewegten System kommen die äußeren Energien Ea (potentielle und kinetische Energie) hinzu:
Die Energie eines abgeschlossenen Systems bleibt unverändert. Verschiedene Energieformen können sich demnach ineinander umwandeln, aber Energie kann weder aus dem Nichts erzeugt noch kann sie vernichtet werden. Deshalb ist ein Perpetuum Mobile erster Art unmöglich (kein System verrichtet Arbeit ohne Zufuhr einer anderen Energieform und/oder ohne Verringerung seiner inneren Energie).
Eine Einschränkung der Umwandelbarkeit von Wärme in Arbeit ergibt sich erst aus dem zweiten Hauptsatz der Thermodynamik.
Energiebilanz für Kreisprozesse

Da nach dem Durchlaufen eines Kreisprozesses das Arbeitsmedium zum Ausgangszustand zurückkehrt, vereinfacht sich die Bilanz, es entfallen die Änderungen der Zustandsgrößen, und es verbleiben die Prozessgrößen Wärme und Arbeit. Wie noch im Zusammenhang mit dem 2. Hauptsatz erläutert wird, kann nicht nur Wärme zugeführt werden, die komplett in Arbeit umgewandelt wird, sondern es muss auch Wärme abgeführt werden. Die einfache Bilanzgleichung lautet:
Dabei summiert das Kreisintegral alle Wärmeströme auf. Sie sind positiv, wenn sie in das System eintreten und negativ, wenn sie es verlassen. WKr ist die gesamte Arbeit des Zyklus. Sie ist negativ, wenn sie abgegeben wird.
Die Beziehung wird auch oft mit den Wärmebeträgen geschrieben:
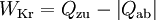 ,
,
wobei die Wärmeabfuhr deutlicher erkennbar wird.
Schließlich sollte auch der thermische Wirkungsgrad einer Kraftmaschine
noch genannt werden, der den Nutzen (die Kreisprozessarbeit) ins Verhältnis zum Aufwand setzt (die zugeführte Wärme, die meist in Form von Brennstoff bezahlt werden muss). Die abgeführte Wärme wird in der Regel von der Umgebung aufgenommen.
Zweiter Hauptsatz
Der zweite Hauptsatz ermöglicht die Einführung der thermodynamischen Entropie als Zustandsgröße zur numerischen und anschaulichen Beschreibung von Prozessen (vergl. T-s-Diagramm) und auch die Definition der thermodynamischen Temperatur. Er schränkt die Aussage des ersten Hauptsatzes über die Gleichwertigkeit von Wärme und Arbeit ein und ist damit eines der Fundamente der Thermodynamik, wird aber im Rahmen dieser Theorie nicht begründet. Erst im Rahmen der Statistischen Mechanik wird er mit den übrigen Theorien der Physik verknüpft: Je nach philosophischem Standpunkt bekommt er dort eine stochastische Formulierung oder wenigstens eine wahrscheinlichkeitsbezogene Begründung.
Die verschiedenen Aussagen
Der Zweite Hauptsatz der Thermodynamik in der Formulierung von Clausius lautet:
Es gibt keine Zustandsänderung, deren einziges Ergebnis die Übertragung von Wärme von einem Körper niederer auf einen Körper höherer Temperatur ist.
Einfacher ausgedrückt: Wärme kann nicht von selbst von einem Körper niedriger Temperatur auf einen Körper höherer Temperatur übergehen. Diese Aussage scheint zunächst überflüssig zu sein, denn sie entspricht der alltäglichen Erfahrung, wie die über die Anziehungskraft der Erde. Dennoch ist sie äquivalent zu allen weiteren, weniger „selbstverständlichen“ Aussagen, denn alle Widersprüche zu den anderen Aussagen lassen sich auf einen Widerspruch zu dieser zurückführen.
Der Zweite Hauptsatz der Thermodynamik in der Formulierung von Kelvin und Planck lautet:
Es gibt keine Zustandsänderung, deren einzige Ergebnisse das Abkühlen eines Körpers und das Heben eines Gewichtes sind.
Dem ersten Hauptsatz würde die Annahme nicht widersprechen, dass es möglich ist, einer – wie immer auch gearteten – Kraftmaschine einen stetigen Wärmestrom zuzuführen, den diese vollständig als mechanische oder elektrische Leistung abgibt. Eine solche Maschine wird als Perpetuum mobile zweiter Art bezeichnet. Eine entsprechende Formulierung des zweiten Hauptsatzes lautet:
Ein Perpetuum mobile zweiter Art ist unmöglich.

Nimmt man an, es gäbe diese von einer Wärmesenke zur Wärmeabfuhr unabhängige Kraftmaschine, so könnte damit der Umgebung, z. B. dem Meerwasser, Wärme entzogen und in mechanische Arbeit umgewandelt werden. Man könnte damit auch gemäß dem Bild rechts die Wärme aus einem Reservoir oder Behälter entziehen und mit der umgewandelten Energie eine Wärmepumpe antreiben, die mit einem reversiblen Carnot-Prozess Wärme aus einem anderen Behälter mit niedrigerer Temperatur in den ersteren mit höherer Temperatur fördert. Die in den wärmeren Behälter eingespeiste Wärmemenge wäre dann größer als die von der Kraftmaschine aufgenommene, weil die abgegebene Energie der Wärmepumpe aus der Summe von aufgenommener Wärme und Antriebsarbeit besteht. Denkt man sich die Systemgrenze um beide Maschinen einschließlich der beiden Wärmebehälter gezogen, so wäre innerhalb dieses abgeschlossenen Systems – also ohne Energie- und Stoffaustausch mit der Umgebung – letztlich Wärme von einem kälteren zu einem wärmeren Körper geflossen. Dies ist ein Widerspruch zur ersten Aussage. Prinzipiell derselbe Widerspruch ergibt sich aber auch mit der Annahme, man könnte eine Kraftmaschine bauen, die einen größeren Wirkungsgrad aufweist als eine mit einem Carnot-Prozess arbeitende Maschine. Auch diese Maschine würde dem wärmeren Behälter weniger Wärme entnehmen als die von ihr angetriebene Carnot-Wärmepumpe dort einspeist. Die entsprechende Aussageform des zweiten Hauptsatzes lautet:
Es gibt keine Wärmekraftmaschine, die bei gegebenen mittleren Temperaturen der Wärmezufuhr und Wärmeabfuhr einen höheren Wirkungsgrad hat als der aus diesen Temperaturen gebildete Carnot-Wirkungsgrad.
Die Nennung der mittleren Temperaturen ist deshalb von Bedeutung, weil in der Regel durch Wärmezufuhr oder Wärmeentnahme ein Wärmereservoir seine Temperatur ändert.
Unmittelbar in diesem Zusammenhang lässt sich weiter formulieren:
Alle reversiblen Wärme-Kraft-Prozesse mit gleichen mittleren Temperaturen der Wärmezufuhr und Wärmeabfuhr haben denselben Wirkungsgrad wie der entsprechende Carnot-Prozess.
und:
Alle irreversiblen Wärme-Kraft-Prozesse haben einen geringeren Wirkungsgrad.
Mit den in der modernen Thermodynamik festgelegten Begriffsdefinitionen (Wärme, Arbeit, Innere Energie, Zustandsgröße, Prozessgröße, adiabat…) und mit der systematischen Einteilung der Systeme kann über die von Clausius eingeführte Zustandsgröße Entropie eine für alle geschlossenen Systeme und Prozesse in offenen Systemen allgemein gültige Aussage des zweiten Hauptsatzes in mathematischer Form gegeben werden (Bei offenen Systemen bezieht sich die Bilanz auf ein Fluidteilchen, das sich durch das System hindurch bewegt und als geschlossenes bewegtes System betrachtet werden kann (siehe oben) ).
Dabei ist δWdiss die innerhalb des Systems dissipierte Arbeit (Arbeit, die nicht nach außen gelangt, sondern infolge von Reibungs-, Drosselungs- oder Stoßvorgängen die innere Energie erhöht). Sie ist immer positiv. Man bezeichnet den entsprechenden Term in der Gleichung als „produzierte Entropie“ – im Gegensatz zum ersten Term, der „transportierte Entropie“ genannt wird und auch negativ sein kann.
Für das adiabate System mit δQ = 0 ergibt sich daraus:
In einem geschlossenen adiabaten System kann die Entropie nicht abnehmen, sie nimmt in der Regel zu. Nur bei reversiblen Prozessen bleibt sie konstant.
Auch hier ist die Äquivalenz mit der ersten Aussage von Clausius leicht
zu erkennen. Ein selbsttätiger Wärmefluss vom kälteren zum wärmeren
Behälter in der oben skizzierten Anordnung würde bedeuten, dass die
Entropie des kälteren Behälters (geringere Temperatur T im
Nenner) stärker abnimmt, als die des wärmeren zunimmt, d.h. die gesamte
Entropie im System abnimmt, was nicht möglich ist.
Alle spontan ablaufenden Prozesse sind irreversibel. Dort findet immer eine Entropiezunahme statt. Beispiele sind die Vermischung von zwei unterschiedlichen Gasen und der Wärmefluss von einem heißen zu einem kalten Körper ohne Gewinnung von Arbeit. Die Wiederherstellung des (oft „geordneter“ genannten) Anfangszustandes erfordert dann den Einsatz von Energie oder Information (siehe maxwellscher Dämon). Reversible Prozesse sind nicht mit einer Erhöhung der Gesamtentropie verbunden und laufen daher auch nicht spontan ab. Durch die theoretische Beschreibung spontan ablaufender Prozesse zeichnet der zweite Hauptsatz der Thermodynamik eine Richtung der Zeit aus, die mit unserer intuitiven Erfahrungswelt übereinstimmt (vergl. das Beispiel weiter unten).
Mit den beschriebenen Zusammenhängen ist auch der folgende Satz eine Aussageform des zweiten Hauptsatzes:
Die Thermische Energie eines Systems besteht aus einem Anteil Exergie und einem Anteil Anergie, wobei der exergetische Anteil verschwindet, wenn das System in den Umgebungszustand übergeführt wird

Die Exergie ist der umwandelbare Anteil thermischer Energie in andere Energieformen. Wird ein Körper bzw. System mit einem Zustand, der von dem der Umgebung abweicht, reversibel in den Umgebungszustand gebracht, so wird seine Exergie als Arbeit abgegeben. Die Wärme, die ein Körper (z. B. ein heißes Rauchgas im Kessel eines Kraftwerks) abgibt, wenn es sich auf Umgebungstemperatur abkühlt, kann theoretisch über eine Folge von differenziellen Carnot-Prozessen, wie im Bild rechts dargestellt, zur Umwandlung in Arbeit genutzt werden. Der exergetische Anteil ergibt sich durch Aufsummieren der differenziellen (pinkfarbenen) Flächenanteile oberhalb der Umgebungstemperatur TU.
Die Wärmesenke für diese Prozesse zur Aufnahme der Anergie (blauer Flächenanteil unterhalb TU) ist die Umgebung. Herrscht bei einem Gas im Ausgangszustand gegenüber dem Umgebungszustand nicht nur eine höhere Temperatur, sondern auch ein höherer Druck, so besteht die gesamte Exergie nicht nur aus dem exergetischen Anteil der Wärme, sondern zusätzlich aus einem Anteil Volumenarbeit.
Der thermische Wirkungsgrad der realen Wärmekraftmaschine ist also immer kleiner als 1 und – bedingt durch die von den Maschinen vorgegebene Prozessführung und die unvermeidlichen dissipativen Effekte – auch immer kleiner als der der idealen Wärmekraftmaschine:
wobei TU die
Umgebungstemperatur ist und 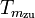 die
mittlere Temperatur der Wärmezufuhr. Sie ergibt sich, wenn die gelbe
Fläche der Exergie durch ein flächengleiches Rechteck oberhalb der
Linie der Umgebungstemperatur ersetzt wird.
die
mittlere Temperatur der Wärmezufuhr. Sie ergibt sich, wenn die gelbe
Fläche der Exergie durch ein flächengleiches Rechteck oberhalb der
Linie der Umgebungstemperatur ersetzt wird.
Der zweite Hauptsatz hat somit erhebliche technische Auswirkungen.
Da viele Maschinen, die mechanische Energie liefern, diese über einen
Umweg aus thermischer Energie erzeugen (z. B. Dieselmotor:
Chemische
Energie
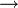 thermische
Energie
thermische
Energie
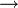 mechanische
Energie),
gelten
für ihre Wirkungsgrade immer die
Beschränkungen des 2. Hauptsatzes. Im Vergleich dazu bieten
Wasserkraftanlagen,
die
bei
der Umwandlung keine Zwischenstufe über thermische Energie
benötigen, erheblich höhere Wirkungsgrade.
mechanische
Energie),
gelten
für ihre Wirkungsgrade immer die
Beschränkungen des 2. Hauptsatzes. Im Vergleich dazu bieten
Wasserkraftanlagen,
die
bei
der Umwandlung keine Zwischenstufe über thermische Energie
benötigen, erheblich höhere Wirkungsgrade.
- Wärme kann nicht von selbst von einem Körper niedriger Temperatur auf einen Körper höherer Temperatur übergehen.
- Wärme kann nicht vollständig in Arbeit umgewandelt werden. Dies wäre eine Realisierung eines Perpetuum Mobile zweiter Art.
- Der Wirkungsgrad des Carnot-Prozesses kann nicht übertroffen werden.
- Alle spontan (in eine Richtung) ablaufenden Prozesse sind irreversibel.
- Alle Prozesse, bei denen Reibung stattfindet, sind irreversibel.
- Ausgleichs- und Mischungsvorgänge sind irreversibel.
- In einem geschlossenen adiabaten System kann die Entropie nicht geringer werden.
- Das Gleichgewicht isolierter thermodynamischer Systeme ist durch
ein Maximalprinzip der Entropie ausgezeichnet.
Dritter Hauptsatz
Dieser Hauptsatz wurde von Walther Nernst im Jahr 1906 vorgeschlagen und ist auch als Nernst-Theorem bekannt. Er ist quantentheoretischer Natur und äquivalent zur Aussage von der Unerreichbarkeit des Nullpunktes der absoluten Temperatur:
- Es ist nicht möglich, ein System bis zum absoluten Nullpunkt abzukühlen.
Bei der Annäherung der Temperatur an den absoluten Nullpunkt (T = 0K) wird die Entropie S unabhängig von thermodynamischen Parametern. Damit geht S gegen einen festen Grenzwert S0:
Die konstante Entropie bei T = 0K
lässt sich als 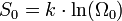 darstellen, wobei k die
Boltzmann-Konstante ist und Ω0
die Anzahl der möglichen
Mikrozustände im Grundzustand (Entartung). Zum Beispiel würde sich für
einen n-atomigen Kristall, dessen
Atome im Energiegrundzustand zwei mögliche Spineinstellungen haben,
darstellen, wobei k die
Boltzmann-Konstante ist und Ω0
die Anzahl der möglichen
Mikrozustände im Grundzustand (Entartung). Zum Beispiel würde sich für
einen n-atomigen Kristall, dessen
Atome im Energiegrundzustand zwei mögliche Spineinstellungen haben, 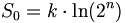 ergeben.
ergeben.
Für alle physikalisch-chemischen Reaktionen, bei denen die teilnehmenden Stoffe am absoluten Nullpunkt als ideale kristalline Festkörper vorliegen, gilt:
Es gibt nur eine Realisierungsmöglichkeit für ideale Festkörper am absoluten Nullpunkt, Ω0 = 1.
Die genannten Aussagen können mit Methoden der Quantenstatistik rigoros bewiesen werden.
Energieberechnungen in der Thermodynamik
Die Energiebilanz hat in der Thermodynamik einen hohen Stellenwert.
Bei einer Phasenumwandlung (fest-flüssig-gasförmig) oder Mischungen (Salz in Wasser, Mischung verschiedener Lösungsmittel) werden Umwandlungsenergien (Schmelzenthalpie, Verdampfungsenthalpie, Sublimationsenthalpie) oder Umwandlungsenthalpien benötigt bzw. werden in umgekehrter Richtung frei. Bei einer chemischen Stoffumwandlung können Reaktionswärmen oder Reaktionsenthalpien frei werden oder müssen umgekehrt zugeführt werden.
Zur Berechnung von frei werdenden Reaktionswärmen bei Stoffumsetzungen wird zunächst die entsprechende Reaktionsgleichung mit den dazugehörigen stöchiometrischen Faktoren aufgestellt. Die Standardbildungsenthalpien der Einzelstoffe sind für 25 °C in Tabellenwerken verzeichnet. Man addiert die Summe der Enthalpien der Produkte entsprechend den stöchiometrischen Faktoren und zieht davon die Enthalpien der Ausgangsstoffe ab (Hess'scher Wärmesatz).
Die Reaktions- oder Umwandlungsenthalpie, die bei einer chemischen Umsetzung oder Phasenumwandlung an die Umgebung abgegeben wird, hat ein negatives Vorzeichen. Ist eine Energiezufuhr von der Umgebung für eine Phasenumwandlung oder eine chemische Umsetzung nötig, so hat diese ein positives Vorzeichen.
Die Zustandsgröße für Enthalpie ist H = U + p*V. Die Freie Enthalpie ist G = H – T*S.
Durch Bildung des totalen Differentials der Freien Enthalpie und der anschließenden Integration lässt sich berechnen, ob eine chemische Umsetzung möglich ist.
ΔG = ΔH – T*ΔS
Ist die Differenz der Freien Enthalpien (ΔG) der Produkte zu den Ausgangsstoffen (Edukte) negativ, ist eine Phasenumwandlung oder eine Stoffumsetzung möglich. Ist die Differenz der Freien Enthalpie einer Reaktion, einer Phasenumwandlung negativ, erfolgt eine Reaktion – soweit diese nicht kinetisch gehemmt ist – bis zu einem Punkt, an dem ΔG = 0 wird. Das Massenwirkungsgesetz ist ein Spezialfall eines solchen Gleichgewichtes. Ist die Differenz der Freien Enthalpie positiv, so ist eine Reaktion oder Phasenumwandlung unmöglich.
Im Jahr 1869 glaubte Marcellin Berthelot noch, dass nur chemische Umwandlungen möglich seien, bei denen Wärme frei wird.
Mitunter ist eine Umwandlung oder eine Reaktion möglich, obgleich dabei keine Reaktionswärme oder Umwandlungswärme frei wird. Dies liegt am Entropieterm T*ΔS.
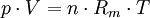
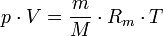
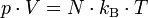
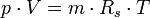
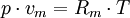
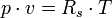
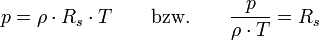
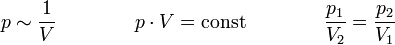
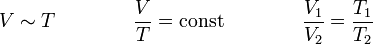
![V(T) = V_0 \left(1 + \gamma_0 [T - T_0]\right) \qquad \text{mit} \qquad \gamma_0 = \frac{1}{T_0} = \frac{1}{273{,}15\ \mathrm{K}}](90e8b90b804dcbc55d70f7f07b2bdfca.png)
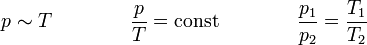
![p(T) = p_0 \left(1 + \gamma_0 [T - T_0]\right) \!](4935808e112b4a9acee4bbeb5218fa9d.png)